Водолазные спуски и их медицинское обеспечение
Уравнение состояния идеального газа
Если зависимость между объемом, давлением и температурой связать воедино и выразить одним уравнением, то получается уравнение состояния идеального газа, которое объединяет законы Бойля - Мариотта и Гей-Люссака. Это уравнение впервые было выведено Б.П.Клайпероном путем преобразований уравнений, предложенных его предшественниками. Уравнение Клайперона состоит в том, что произведение давления газа данной массы на объем, деленное на абсолютную температуру, есть величина постоянная, не зависящая от состояния, в котором находится газ. Одна из форм написания этого уравнения:

Для массы газа в 1 кг это уравнение будет иметь вид:
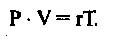
В этом случае газовая постоянная г будет зависеть от природы газа. Д.И.Менделеев показал, что если массой газа является моль (грамм молекула), то газовая постоянная R является универсальной и не зависит от природы газа. Для массы газа, равной 1 молю, уравнение примет следующий вид:

Для 1 моля любого газа значение R будет одно и то же, в связи с чем R называют универсальной газовой постоянной. Численное значение R определяется из условия, что при температуре О °С (или 273 К) и давлении 760 мм рт.ст. (или 101 325 Па) объем моля V0 = 22,4 л/моль (или 0,0224 м3/моль). Из этого следует: