Водолазные спуски и их медицинское обеспечение
Теплоемкость газов
Температура является мерой средней кинетической энергии хаотического движения молекул в макроскопических телах.
Теплоемкость любого вещества определяется количеством тепла, потребным для нагревания массовой единицы этого вещества (например, 1 кг) на 1 °С (или на 1 К). Этот коэффициент называется удельной теплоемкостью. Теплоемкость тела, рассчитанная на моль вещества, называется молярной теплоемкостью.
У газов различают теплоемкость при постоянном давлении (Ср), когда при нагревании увеличивается объем данного количества газа, и теплоемкость при постоянном объеме (Су), когда возрастает давление газа. Теплоемкость данного газа при постоянном давлении больше, чем его теплоемкость при постоянном объеме:
Ср > C v.
Это зависит от того, что всякий газ, расширяясь, совершает определенную работу. На это и уходит часть энергии в виде тепла.
Молярная теплоемкость при постоянном объеме для одноатомных (инертных) газов (гелия, неона, аргона и др.) равна 3 кал (Cv = 3 кал/град). Это значит, что для нагревания 1 моля одноатомного газа на 1 °С нужно затратить при постоянном объеме 3 калории. Теплоемкость одноатомных газов при постоянном давлении равна 5 кал (Ср = 5 кал/град), т.е. для нагревания 1 моля одноатомного газа на 1 °С нужно затратить при постоянном давлении 5 калорий.
Для двухатомных газов (водород, кислород, азот и др.) теплоемкость при постоянном объеме C v = 5 кал/град, а при постоянном давлении Ср = 7 кал/град. Из этого следует различная удельная теплоемкость разных газов.
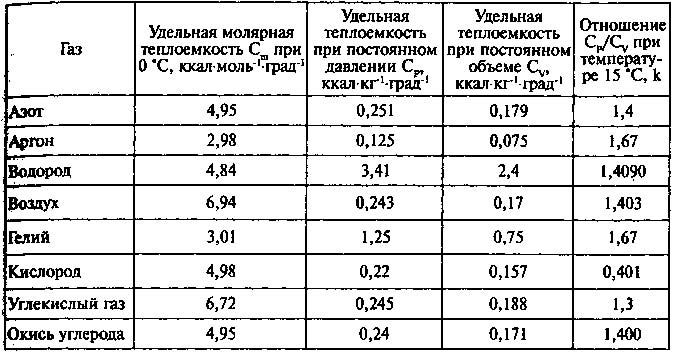
Значения удельных теплоемкостей представлены в табл. 4.
Таблица 4. Удельные теплоемкости газов
Лучший интернет магазин электроники с низкими ценами
