Водолазные спуски и их медицинское обеспечение
Растворимость газов в жидкостях
Основные физико-химические закономерности растворимости газов в жидкостях впервые были изучены И.М.Сеченовым.
Известно, что всякий газ, приведенный в соприкосновение с жидкостью, будет в ней растворяться. По закону Генри растворимость в жидкостях прямо пропорциональна при данной температуре давлению (при отсутствии химического взаимодействия). Если в жидкости (воде, крови и т.д.) растворяется одновременно несколько газов, то растворение каждого из них происходит независимо друг от друга пропорционально величине его парциального давления в данной газовой среде.
Следовательно, растворение газа в жидкости зависит от величины давления газа над жидкостью. Оно будет происходить до тех пор, пока давление газа в жидкости не станет равным его давлению над жидкостью.
Кроме того, количество растворенного в жидкости газа и коэффициент растворимости зависят от химической природы газа и его температуры. Коэффициентом растворимости называется количество газа (см3), измеренного при О °С и 760 мм рт.ст., которое может раствориться в 1
см3(1 мл) жидкости при данной температуре. Так, например, в 1 см3 воды при давлении кислорода в 1 кгс/см2 и температуре 40 °С растворяется 0,0231 см3 кислорода. Поскольку в атмосферном воздухе содержится около 21 % кислорода (парциальное давление 159 мм рт.ст.), количество кислорода, растворенного в 1 см3 воды, в этих условиях составит:
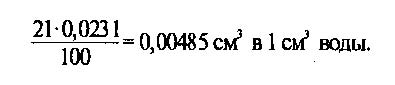
Растворимость газов зависит также от вида растворителя. Так, например, установлено, что один и тот же газ по-разному растворяется в воде и в масле. Отношение количества газа, растворенного в масле, по отношению к его количеству, растворенному в воде, называется коэффициентом распределения, жиро-водным коэффициентом или по фамилиям авторов установления этой закономерности - овертон-мейеровским коэффициентом. Значение коэффициентов растворимости различных газов и коэффициентов распределения позволяет ориентировочно узнать, как тот или иной газ может раствориться в различных тканях организма человека, находящегося в условиях повышенного давления газовой среды.
Значения этих коэффициентов приведены в табл. 6.
Сравнивая коэффициенты растворимости гелия, азота и аргона, можно видеть, что гелия должно растворяться в жидких средах меньше, чем азота. Кроме того, гелий в меньшем количестве по сравнению с азотом переходит из крови в ткани вследствие меньшего коэффициента распределения. Аргон растворяется в жидкостях вдвое больше азота, еще больше различие их растворимости в отношении жировой ткани.
Коэффициенты растворимости газов в крови и других жидкостях представлены в табл. 7.
Из таблицы следует, что в каждом литре крови при температуре 38 °С и давлении 1 кгс/см2 может раствориться 23 см3 кислорода, 470 см3 углекислого газа, 14,9 см3 водорода и 13 см3 азота.
С увеличением температуры растворимость газов уменьшается, о чем свидетельствуют данные табл. 8.
Объем растворенного в организме газа будет одинаков независимо от того, дышит человек воздухом под давлением 1 или 3 кгс/см2. Массовое же количество газа будет увеличиваться пропорционально величине давления. Например, ткани, насыщенные азотом в обычных условиях соответственно его парциальному давлению в атмосферном воздухе, содержат 0,0146 см3 азота на 1 г ткани (см. насыщение клеток в табл. 7). При погружении водолаза на глубину 20 м он будет дышать воздухом под давлением 3 кгс/см2.
